|
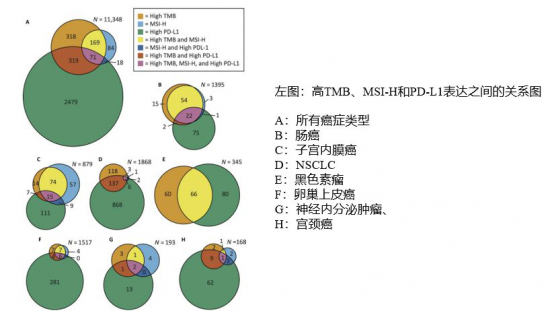
2018年頒發的諾貝爾生理學獎或醫學獎將“癌癥免疫治療”推到了舉世矚目的位置。相比化療對正常細胞的副作用、靶向治療的局限性和耐藥性,這種通過激活病人自身免疫系統去攻擊腫瘤細胞的治療方法不直接損傷反而增強免疫系統,可以治療多種癌癥,對很多病人有效,在理論上具有巨大優勢。目前免疫治療已在多種腫瘤如黑色素瘤、非小細胞肺癌、腎癌和前列腺癌等實體瘤的治療中展示出了強大的抗腫瘤活性,多個腫瘤免疫治療藥物已經獲得美國FDA臨床應用批準。作為中國腫瘤精準醫療領域先行者,泛生子致力更加精準地“引路”免疫治療。在未經篩選的患者中,免疫治療的有效率只有10%~30%。泛生子科學設計捕獲區域,采用國際主流算法,聯合多檢測平臺為臨床提供TMB、PD-L1、MSI、MMR等免疫治療相關生物標志物的檢測(825基因檢測),可有效鎖定免疫治療獲益人群,評估免疫治療療效。 1.?免疫治療 腫瘤免疫治療已成為時下熱門研究方向,并在臨床不斷收獲可喜佳績。但腫瘤免疫治療需要全面綜合地分析,不能單一研究腫瘤Biomarker而忽略腫瘤的微環境影響,只有將二者結合起來,才能實現更有意義的預測、指導作用。 目前,免疫治療的主要參考的指標有MSI/dMMR、PD-L1、TMB等biomarker,這些biomarker都能夠預測免疫檢查點抑制劑的療效,那么單獨檢測每一個biomarker可以嗎? 研究表明MSI-H、TMB與PD-L1高表達重疊性差。Checkmate026研究顯示,高TMB同時PD-L1≥50%獲益增加。因此多指標聯合檢測,能夠更加有效的評估免疫治療的療效。
免疫治療biomarker大匯總 1.?PD-L1 PD-L1是一種表達于細胞表面的蛋白(主要是腫瘤細胞,及一些宿主細胞),可與T細胞上的PD-1結合,傳導免疫抑制信號,從而抑制效應T細胞的活性來阻礙其對腫瘤細胞的殺傷,相當于免疫系統的剎車,而免疫檢查點抑制劑能夠松開剎車,激活T細胞殺傷腫瘤細胞,抑制腫瘤生長。多項臨床研究證實,無論是一線治療(初治),還是二線治療(經治),PD-L1高表達的患者,更有可能免疫治療獲益。 全球已經有7種PD-1/PD-L1抑制劑獲批上市,包括首個國產PD-1單抗——特瑞普利單抗注射液,進口藥包括患者較熟悉的K藥(keytruda/PD-1/默沙東)、O藥(Opdivo/PD-1/百時美施貴寶)和T藥(Tecentriq/PD-L1/羅氏),以及國內患者可能不太熟悉的B藥(Bavencio/PD-L1/輝瑞&默克)、I藥(Imfinzi/PD-L1/阿斯利康)及L藥(Libtayo/PD-1/再生元&賽諾菲),已經被美國/歐洲等國家批準用于共計十幾種癌癥的治療,包括黑色素瘤、肺癌、肝癌和胃癌等。
NCCN指南推薦,部分癌種若要進行免疫檢查點抑制劑的治療,需進行PD-L1表達量的檢測(Pembrolizumab為“K藥”) PD-L1的檢測結果,對臨床醫師制定治療方案,預估療效非常重要。目前,FDA已批準四款PD-L1 檢測試劑盒,其中Dako22C3為作為K藥的伴隨診斷檢測,其他可作為免疫檢查點抑制劑的補充診斷檢測。 2.MSI-H/d-MMR MSI-H(microsatellite instability-high),即高度微衛星不穩定性; dMMR(mismatch repair deficient),即錯配修復缺陷。同時,MSI-H是由dMMR導致的。MSI-H/dMMR突變在很多實體瘤中都存在,且臨床指導意義非常類似。發生MSI-H/dMMR的實體腫瘤患者通常具有免疫原性和廣泛的T細胞浸潤性,從而對免疫檢查點抑制劑的治療有著較好的應答。
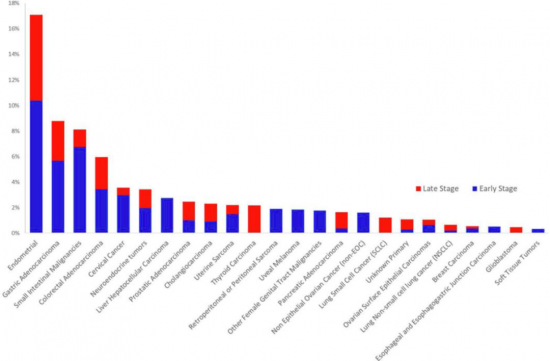
各腫瘤亞型發生dMMR的比例:dMMR腫瘤在32個腫瘤亞型中檢測到24個,多在早期(定義為< IV期)發現 2017年5月,FDA批準Keytruda成為首款“廣譜抗癌藥”,用于治療“MSI-H/dMMR亞型”的實體瘤。這是FDA批準的首例不依據腫瘤來源,而是依據腫瘤基因學特征進行區分的抗腫瘤療法。自此,精準醫療邁出了里程碑式的一步! 此后,2017年6月8日,發布在《Science》的研究顯示,在86例dMMR的腫瘤患者中,Keytruda在結直腸癌中客觀緩解率和疾病控制率分別為52%和82%,在非結直腸癌中分別為54%和72%,表明不管是結直腸癌還是其他實體瘤,只要患者具有MSI-H的特征,使用Keytruda的療效都非常好[2]。
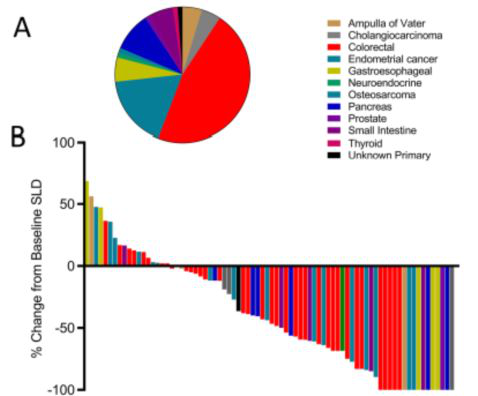
圖A:每種顏色代表一個dMMR癌種。 圖B:每根柱子代表一個dMMR患者在接受Keytruda治療后20周腫塊大小的變化情況。很大一部分患者腫塊縮小,部分患者縮小的比例為100%,也就是完全消失。 除了K藥,2017年8月,FDA又批準了PD-1免疫檢查點抑制劑Opdivo用于既往接受氟尿嘧啶、奧沙利鉑、伊立替康治療后,病情發生進展且攜帶MSI-H或dMMR的轉移性結直腸癌(mCRC)成人及12歲及以上兒科患者的治療。 3.TMB 腫瘤突變負荷(Tumor Mutation Burden,TMB)是指一份腫瘤樣本中,所評估的編碼基因組每兆堿基中發生的體細胞編碼檢測的置換和插入或缺失突變的總數。免疫治療是否有效,主要依賴于免疫細胞對癌細胞特異性抗原的識別,而理論上講,基因突變越多癌細胞產生的新抗原越多,被免疫細胞識別的可能性就越高。因此,TMB越高,患者或許從免疫治療中獲益越多。
約翰.霍普金斯大學的Elizabeth Marion Jaffee教授通過回顧性分析多個臨床研究發現:TMB與腫瘤免疫治療客觀反應率之間存在顯著的相關性(P<0.001),相關系數為0.74,表明約55%的不同類型癌癥中,客觀緩解率的差異可以通過TMB來解釋,強調了TMB與多種癌癥中PD-1治療的效果之間存在相關性[3]。
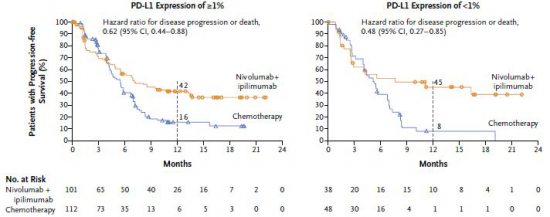
來自于CheckMate227的研究成果更能夠真正體現TMB的實力。該研究采用FoundationOne CDx(FDA獲批NGS大Panel之一)對TMB進行檢測,結果表明:在TMB≥10 mut/Mb的晚期非小細胞肺癌患者中,無論PD-L1表達水平如何,與鉑類雙聯化療相比,采用nivolumab(“O藥”)加低劑量ipilimumab(商品名為Yervoy,CTLA-4抑制劑)的免疫檢查點抑制劑治療的患者明顯延長了1年的無進展生存率(42.6%vs13.2% ),無進展生存期也顯著延長(7.2月 vs 5.5月)[4]。 與此同時,另一項并列開展中的CheckMate568也表明,無論PD-L1表達水平如何,TMB≥10 mut/Mb的患者中位無進展生存期幾乎是TMB<10 mut/Mb患者的3倍(7.1月 vs 2.6月)。
無論PD-L1表達水平如何,TMB≥10 mut/Mb的患者中位無進展生存期高于TMB<10 mut/Mb 這兩個研究奠定了TMB在預測免疫治療效果中的地位,于是,在2019年第一版非小細胞肺癌(NSCLC) NCCN指南中,新增了推薦腫瘤突變負荷(TMB)用于識別適合接受 “Nivolumab + ipilimumab” 和 “Nivolumab” 的NSCLC患者,但尚無關于如何測量TMB的指南性共識。
盡管WES(全外顯子組檢測)是檢測TMB的經典方法,但考慮到檢測所需的時間、成本等因素,通過NGS大panel檢測TMB將成為目前臨床更優的選擇。泛生子實體瘤825基因檢測通過科學設計捕獲區域(覆蓋區域>1Mb,并參考FDA獲批的兩個NGS大panel產品—F1CDX和MSK-IMPACT),采用國際主流算法,與WES及F1CDX進行TMB評估結果對比,一致性較高,R2>0.9。 4.免疫治療相關基因變異 除以上biomarker之外,患者對免疫治療的響應程度還與其他多種因素有關。例如基因突變。通過對免疫治療患者基因突變情況的回顧性分析可知:不同基因的突變可能導致免疫治療效果的諸多差異。基因檢測在腫瘤治療過程中的作用已經不止于指導靶向治療,它還有更大的應用范圍,比如輔助判斷免疫治療的療效,并且,顯而易見的是,更多更全面的基因檢測會給治療帶來更全面的指導。 NGS大panel助力免疫治療探索之路 免疫治療相關biomarker還有待進一步研究及完善,如各biomarker間相互作用與免疫治療的關系、免疫微環境對免疫治療的影響、腸道菌群對免疫治療的影響等等,這些研究都不開NGS技術的支持,基于NGS技術的大Panel在免疫治療指導及科研探索將發揮越來越大的作用。 泛生子實體瘤825基因檢測產品基于高通量、高靈敏度的NGS平臺和“雜交捕獲”技術,一次性檢測825個癌癥相關基因,涵蓋了更新版本的WHO、NCCN、ESMO等權威指南及專家共識推薦檢測基因,并結合泛生子基因上萬例中國腫瘤患者的基因突變區域和遺傳突變位點信息開發設計,多平臺的聯合應用可提供多維度的免疫治療相關生物標志物檢測(TMB、MSI、PD-L1、免疫療效相關基因變異),從而更精準的指導腫瘤患者的個體化診療,為實體瘤患者提供更多生存獲益的可能,亦為科研人員提供更加全面的參考信息。 目前,越來越多的中國基因檢測企業在免疫治療領域在國際上獲得了包括CLIA與CAP等室間質評認證,得到國內外的高度認可;同時,中國的基因檢測技術也正在與世界接軌,不斷取得技術性突破。對于腫瘤免疫治療來說,接下來最重要的工作就是將更多科研成果應用于臨床,使更多患者受益,在這一點上,中國的基因檢測企業還有一段很長的路要走。 |
- 關注天氣: